Neste artigo mostramos como preparamos um display para facilitar a visualização do conceito de mol. Nele, selecionamos diversos elementos e compostos e mostramos qual é a massa em gramas que corresponde a 1 mol de cada substância.
Faça o seu
Para fazer o display, resolvemos usar tubos de plástico com tampa que se assemelham a tubos de ensaio. Estes tubos são, na verdade, pré-formas de garrafas de PET, ou seja, são tubos usados em fábricas de bebidas para se fazer garrafas de 2 litros. Na fábrica, os tubos são aquecidos e colocados em um molde, e soprados contra o molde com uma grande pressão de ar. Nós conseguimos nossos tubos como doação, em uma fábrica de refrigerantes. Você pode encontrar tubos semelhantes em lojas de embalagens. Nosso tubo tem cerca de 40 mL de volume interno. Esse será o principal limitante, na escolha de quais substâncias mostrar no display. Você pode usar outro tipo de frasco com tampa, e assim conseguir mostrar outros materiais com massas molares maiores e que não caberiam nos tubos.
Nós usamos o corte a laser para criar um suporte para os tubos, feito a partir de uma chapa de MDF de 6 mm de espessura. Veja o desenho abaixo.
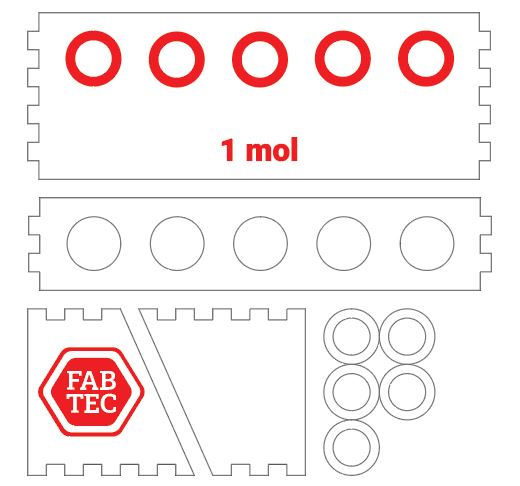
Cortamos e colamos as peças com cola branca. As áreas em vermelho são gravadas na superfície da madeira, e os círculos cortados são colados na base do suporte, para guiar o fundo das pré-formas.
Fizemos um display apenas para metais, contendo 1 mol de ferro, cobre, zinco, alumínio e chumbo. Usando uma balança, cortamos pedaços de barras dos metais e fomos ajustando até termos a massa necessária para 1 mol de cada elemento.
Em um segundo suporte, colocamos outras substâncias, como água, carbono (grafite), cloreto de sódio e óxido de cálcio. Rotulamos todos os tubos com o símbolo e a massa molar da substância.


Usando na sua aula
Existem várias maneiras para se abordar o conceito de mol. Podemos focar no fato de que o mol é uma unidade do SI – Sistema Internacional de Unidades, uma unidade de quantidade de matéria. Podemos também notar que o mol está ligado à constante de Avogadro – o número de átomos, íons ou moléculas presentes em 1 mol da substância especificada. Muitas vezes essa apresentação da constante de Avogadro é feita com uma comparação com expressões usadas para denotar múltiplos de alguma coisa, como dúzias, centos, etc.
De qualquer forma, a maneira pela qual nós interagimos com o mol não está relacionada com o número de partículas de uma amostra, algo a que não temos acesso, mas sim com a sua massa. Nós podemos pesar uma amostra de uma determinada substância e determinar quantos mols dessa substância estão presentes. Para isso, precisamos conhecer a fórmula da substância e assim calcular a sua massa molar. A massa molar é a massa de 1 mol daquela substância.
O nosso display pode contribuir para chamar a atenção dos alunos de que a massa molar de cada substância é diferente, embora em todos os casos estejamos diante da mesma quantidade de matéria: 1 mol. Nós passamos os displays pela turma, chamando a atenção para as diferentes quantidades em massa de cada tubo. Na sequência, nós fazemos exercícios nos quais os alunos devem consultar a tabela periódica e calcular a massa molar de diversas substâncias.
Finalmentes
Este display está disponível para empréstimo para professores de Química de Belo Horizonte e região na sala do projeto XCiência, no COLTEC – UFMG. Venha nos visitar!
Gostou de mais este recurso para as suas aulas de Química? Você acha que este tipo de recurso ajuda muito os alunos a visualizarem e compreenderem melhor os conceitos? Comente e compartilhe com seus colegas.

