Existem diversas maneiras de se mostrar como funciona uma pilha. A pilha de batata é, sem dúvida, uma das mais curiosas. Os alunos podem usar este experimento para explorar diversas partes de um circuito que contém uma pilha: localizar os polos positivo e negativo, ver como funciona uma ligação em série de pilhas e perceber a importância de um eletrólito.
Preparando o experimento
Você vai precisar de:
2 placas de cobre
2 placas de zinco (ou de aço galvanizado)
1 relógio digital com fios e garras jacaré
1 fio encapado com 2 garras jacaré nas pontas
2 batatas ou outros vegetais (limão, tomate, etc.)
1 suporte feito na impressão 3D (opcional)


O design para o suporte foi feito no TinkerCAD e ele foi impresso em PLA.
Abra o compartimento do relógio digital onde fica a bateria (ou pilha). Localize os contatos da bateria para o polo positivo e o negativo. Vamos soldar um fio encapado de cor vermelha no polo positivo e um fio de cor preta no polo negativo. Na outra ponta dos fios, soldamos uma garra jacaré da mesma cor do fio.
Preparamos um fio de outra cor (nós usamos amarelo) com duas garras jacaré nas pontas.
Coloque as batatas ou outro vegetal no suporte. O experimento está pronto para o uso.
Usando o experimento em aula
O material pode ser usado como uma demonstração ou como um experimento feito pelos alunos. No caso de uma demonstração, você pode mostrar a montagem com as batatas no suporte e dizer que você tem um relógio digital, mas que ele está sem pilhas. E que você vai construir uma pilha usando as batatas e placas de cobre e zinco. Coloque uma placa de cobre e uma placa de zinco em cada batata. Se você já trabalhou com os alunos o conceito de potencial de redução, você pode perguntar a eles qual dos metais tem uma maior facilidade de sofrer oxidação. Você pode então escrever a semi-reação de oxidação do zinco no quadro:
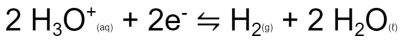
O polo da pilha onde acontece a redução é o polo positivo. Assim, você pode conectar o jacaré vermelho à placa de cobre e o jacaré preto na placa de zinco. Ligue também as placas nas duas batatas que estão desconectadas com o fio que possui dois jacarés. O relógio deve ligar assim que você conectar os fios.
Veja o experimento no vídeo abaixo.
O que acontece
Como vimos acima, o funcionamento da pilha se dá devido a uma reação de oxi-redução. Em uma pilha, a reação de oxi-redução é separada em seus dois componentes. De um lado temos a reação de oxidação, neste caso ocorrendo na superfície da placa de zinco. Esta reação libera elétrons que andam pelo fio ligado à placa de zinco, passam pelo relógio digital, fazendo com que ele funcione e chegam na placa de cobre. A placa de cobre é onde irá ocorrer a reação de redução. O cobre na verdade não participa da reação, está apenas funcionando como um condutor elétrico. Poderíamos usar aqui um eletrodo inerte, como uma barra de grafite. Os elétrons que chegam na placa de cobre fazem com que os íons hidrogênio presentes na água da batata se reduzam, formando uma pequena quantidade de gás hidrogênio.
Poderíamos pensar que a pilha só irá parar de funcionar quando todo o zinco tiver oxidado. Na realidade, muito antes de toda superfície do zinco se oxidar, a placa vai se tornando cada vez menos condutora e a água presente na batata vai evaporando, fazendo com que a pilha deixe de funcionar. Mas se você lixar as placas e trocar a batata, o relógio volta a funcionar. Descarte o vegetal após o uso na pilha, ele se torna impróprio para consumo.
Finalmentes
Gostou do experimento? Não deixe de conhecer nossos outros artigos sobre esse tema:
Pilha de pepino – http://www.xciencia.org/2023/10/31/pilhas-de-pepino/
A pilha humana – http://www.xciencia.org/2023/09/14/a-pilha-humana-uma-eletroquimica-diferente/
Experimentos com pilhas do pontociência – http://www.xciencia.org/2020/06/23/experimentos-com-pilhas/

